
Una de las primeras pistas verdaderamente importantes que llevaron a desentrañar la estructura atómica implicaba el estudio de la emisión y absorción de luz por los átomos de diferentes elementos. Los físicos sabían por la teoría de Maxwell que la luz es emitida y absorbida solo por cargas aceleradas. Esto sugería que el átomo podría contener cargas en movimiento. Podía esperarse por tanto que los patrones y las regularidades en las propiedades de la luz emitida proporcionasen indicios sobre la naturaleza precisa de los movimientos de estas cargas. Los resultados de este estudio fueron tan importantes para desentrañar la estructura atómica que necesitaremos revisar su desarrollo aquí con cierto detalle [1]. Empezamos con los espectros de emisión.
Se sabía desde hacía mucho tiempo que se emite luz por gases o vapores cuando se excitan en una de las siguientes formas:
(1) calentando el gas a una temperatura alta, como cuando una sustancia volátil se pone en una llama;
(2) por una descarga eléctrica a través del gas en el espacio entre los terminales de un arco eléctrico; o
(3) por una corriente eléctrica continua en un gas a baja presión, como en los letreros de neón.
El físico Thomas Melvill realizó los primeros experimentos sobre la luz emitida por varios gases excitados en 1752 [2]. Puso una sustancia tras otra en una llama, «después de haber colocado un cartón con un agujero circular entre mi ojo y la llama […], examiné la constitución de estas diferentes luces con un prisma ”. Melvill descubrió que el espectro de luz visible de un gas caliente de un solo elemento era diferente del conocido espectro arcoiris de un sólido o líquido calientes. El espectro de Melvill no era un continuo ininterrumpido de colores del violeta al rojo. Por el contrario, consistía en trozos aislados, cada uno con el color de esa parte del espectro continuo en el que se localizaba. Había espacios oscuros o, dicho de otra forma, faltaban colores entre los trozos.
Más tarde, se generalizó el uso de una ranura estrecha a través de la cual se dejaba pasar la luz. Los trozos de color de Melvill se convirtieron en líneas [3]. Estos espectros muestran que la luz emitida por un gas es una mezcla de solo unos pocos colores definidos o, en general, de subconjuntos de longitudes de onda muy restringidos. Estos tipos de espectros se denominan espectros de emisión y su estudio se conoce como espectroscopia.

Melvill también señaló que los colores y las ubicaciones de las líneas [3] eran diferentes cuando se ponían diferentes sustancias en la llama. Por ejemplo, con la sal de mesa común en la llama, el color dominante era «amarillo brillante» (ahora se sabe que es característico del elemento sodio). De hecho, el espectro de emisión es muy diferente para cada gas químicamente disitnto porque cada elemento químico emite su propio conjunto característico de longitudes de onda. [4]
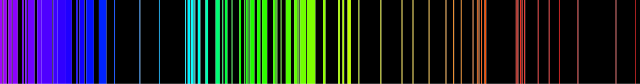
Algunos gases tienen espectros de emisión relativamente simples. Así, la parte más prominente del espectro visible del vapor de sodio es un par de líneas amarillas brillantes. Esta es la razón por la cual, por ejemplo, la llama en una estufa de gas se vuelve amarilla cuando la sopa, o cualquier líquido que contenga sal, cae sobre ella al hervir. Algunos gases o vapores tienen espectros muy complejos. El vapor de hierro, por ejemplo, tiene unas 6000 líneas brillantes solo en el rango visible.
En 1823, el astrónomo John Herschel sugirió que cada gas podría identificarse por su espectro de emisión característico. A principios de la década de 1860, el físico Gustav R. Kirchhoff y el químico Robert W. Bunsen habían descubierto conjuntamente dos elementos nuevos (rubidio y cesio) al observar líneas de emisión no reportadas previamente en el espectro del vapor de un agua mineral. Este fue el primero de una serie de descubrimientos basados en espectros de emisión. Con él comenzó el desarrollo de una técnica para el análisis químico rápido de pequeñas cantidades de materiales mediante espectroscopía.
Notas:
[1] Para ello, a lo largo de entradas sucesivas seá necesario que aparezcan algunas ecuaciones matemáticas. Como siempre en nuestras series serán muy simples y solo utilizarán poco más que las cuatro reglas de la aritmética más elemental. Merecerá la pena el esfuerzo extra.
[2] No, no es una errata. A mediados del siglo XVIII, exactamente el mismo año en el que Benjamin Franklin llevaba a cabo en una colonia británica llamada Pennsylvania un experimento con cometas, llaves y rayos.
[3] Estas líneas brillantes son, de hecho, imágenes a color de la ranura. Cuando se habla de líneas del espectro estamos asumiendo que hay una rajita en alguna cosa opaca por la que se deja pasar la luz. Dicho de otra forma, las líneas espectrales son líneas porque los instrumentos usan ranuras, no porque se emitan como líneas.
[4] Al mirar una fuente gaseosa sin la ayuda de un prisma o una rejilla, nuestro encéfalo combina los colores separados. Percibe la mezcla como rojiza para el neón, azul pálido para el nitrógeno, amarillo para el vapor de sodio (aun el de muchas de las farolas de muchas ciudades españolas), y así sucesivamente.
[5] La «prueba de llama» suele ser hoy día una práctica de laboratorio muy simple en los primeros cursos de introdución a la química.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Los espectros de absorción de los gases — Cuaderno de Cultura Científica
[…] una mejor comprensión tanto de los espectros de los gases, tanto de los de absorción como los de emisión. Ya se sabía que las dos líneas amarillas prominentes en el espectro de emisión del vapor de […]
Los espectros de absorción de los gases – Fluceando
[…] una mejor comprensión tanto de los espectros de los gases, tanto de los de absorción como los de emisión. Ya se sabía que las dos líneas amarillas prominentes en el espectro de emisión del vapor de […]
Las líneas de Balmer — Cuaderno de Cultura Científica
[…] todos los espectros, el espectro de emisión del hidrógeno es especialmente interesante por razones históricas y teóricas. En las regiones […]
Las líneas de Balmer – Fluceando
[…] todos los espectros, el espectro de emisión del hidrógeno es especialmente interesante por razones históricas y teóricas. En las regiones […]
La distancia a las estrellas — Cuaderno de Cultura Científica
[…] de la luz. Espectro de emisión en la región visible del vapor de hierro. Imagen: Wikimedia […]
Nudos en el éter — Cuaderno de Cultura Científica
[…] se usaba para proveer hipótesis que justificasen los datos experimentales. La consecución de los espectros de los distintos elementos ponía de manifiesto que existía una relación entre la radiación, la […]
¿Cómo saben los astrónomos de qué está hecha una estrella si no podemos ir a tomar muestras?
[…] otro lado, Thomas Melvill, desde 1752, había observado algo peculiar al quemar sales. El espectro de estas no era un […]