
Cuando Bohr propuso su modelo en 1913, solo se conocían las líneas de emisión del hidrógeno en las series Balmer y Paschen. Balmer había sugerido, y el modelo de Bohr concordaba con ello, que deberían existir series adicionales.
Experimentos contemporáneos y posteriores descubrieron la serie de Lyman en la porción ultravioleta del espectro (1904–1914), la serie de Brackett (1922) y la serie de Pfund (1924), estando estas últimas en la región infrarroja del espectro. En cada serie se encontró que las frecuencias medidas de cada una de las líneas eran las predichas por el modelo de Bohr y, lo que es más importante, no aparecían líneas que no se correspondiesen con el modelo. Del mismo modo, el modelo de Bohr podía explicar la fórmula general que Balmer supuso que podría aplicarse a todas las líneas espectrales de hidrógeno. Descritas términos empíricos, las líneas de la serie de Lyman corresponden a transiciones de varios estados iniciales al estado final nf =1; las líneas de la serie Paschen corresponden a transiciones de varios estados iniciales al estado final nf = 3; y así sucesivamente, como lo indica la expresión derivada a partir del modelo de Bohr:
1/λ = RH (1/nf2 – 1/ni2)
El esquema general de posibles transiciones entre las primeras seis órbitas se muestra en la figura 1.
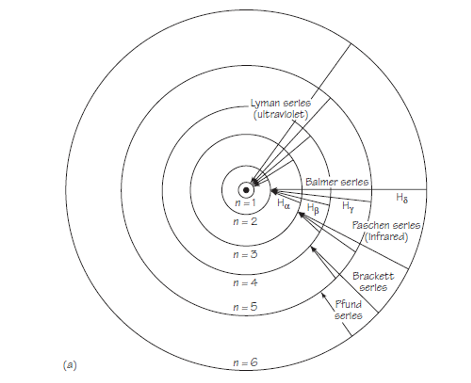
Por lo tanto, el modelo no solo relacionó información conocida sobre el espectro de hidrógeno, sino que también predijo correctamente las longitudes de onda de series de líneas previamente desconocidas en el espectro. Además, proporcionó un modelo físico razonable; la fórmula general de Balmer no había proporcionado ninguna razón física para la relación empírica entre las líneas de cada serie.
El diagrama de la figura 1 es útil como ayuda para la imaginación. Pero tiene el peligro de ser demasiado específico. Por ejemplo, puede llevar a pensar en la emisión de radiación como «saltos» reales de electrones entre órbitas. [*]
Existe otra forma de presentar los resultados de la teoría de Bohr que produce los mismos resultados pero no se adhiere tan estrechamente a una imagen de órbitas. Este nuevo esquema se muestra en la figura 2. No se centra en las órbitas sino en los estados de energía posibles correspondientes. Todos estos estados de energía vienen dados por la expresión para la energía del estado estacionario, En = 1/n2 ·E1 .
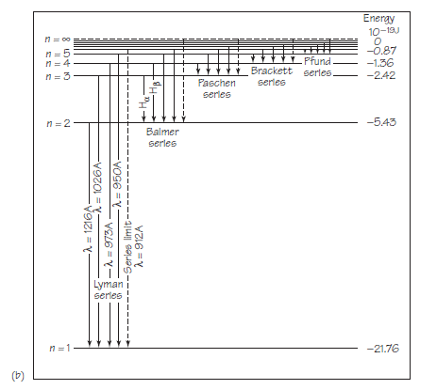
En términos de este modelo matemático, el átomo normalmente no está excitado, con una energía E1 de aproximadamente 13,6 eV (o 22 1019 J). La absorción de energía puede colocar a los átomos en un estado excitado, con una energía correspondientemente más alta. El átomo excitado está entonces listo para emitir radiación, con la consiguiente reducción de energía. La energía absorbida o emitida siempre cambia la energía total del átomo a uno de los valores especificados por la fórmula para En. Por lo tanto, el átomo de hidrógeno también puede representarse, no por órbitas, sino por medio de un diagrama de niveles de energía.
Nota:
[*] Es necesario profundizar un poco más en la cuántica para comprender que esto no es posible, porque no podemos, de entrada, localizar un electrón. Lo veremos en una próxima serie.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Oxígeno en la galaxia más lejana conocida
[…] danés Niels Bohr. Bohr asoció la emisión de luz por parte de los elementos químicos con el comportamiento de los electrones en sus órbitas alrededor del núcleo […]