Si suponemos, como hizo Rutherford, que un átomo consiste en un núcleo cargado positivamente rodeado de varios electrones cargados negativamente, ¿qué impide que los electrones y el núcleo se unan debido a la atracción eléctrica? Una posible respuesta es que un átomo podría ser como un sistema planetario, con los electrones girando en órbitas alrededor del núcleo [1]. Podemos pensar en un planeta que orbita alrededor del Sol como sujeto a una fuerza atractiva hacia el centro [2]. Si no fuese así el planeta seguiría en línea recta, de acuerdo con la primera ley del movimiento de Newton. Esta fuerza hacia el centro a menudo se llama fuerza centrípeta. Para los planetas, esta fuerza surge de la atracción gravitacional del Sol sobre el planeta [2]. Para el caso de los electrones en los átomos Rutherford sugirió que, haciendo el papel de fuerza gravitacional, la fuerza de atracción eléctrica entre el núcleo y el electrón suministraría una fuerza centrípeta. Esta fuerza centrípeta mantendría en órbita al electrón en movimiento.
La idea parece ser una buena base para un modelo útil de la estructura atómica. Pero surge un grave problema con respecto a la estabilidad de un átomo «planetario». Según la teoría del electromagnetismo de Maxwell, una partícula cargada pierde energía cuando se acelera. Un electrón que se mueve en una órbita alrededor de un núcleo cambia continuamente su dirección, por lo tanto, también su vector de velocidad. En otras palabras, siempre está siendo acelerado por la fuerza eléctrica centrípeta.
El electrón, por lo tanto, debería perder energía emitiendo radiación y, por lo tanto, acercándose constantemente al núcleo. En muy poco tiempo, el electrón que pierde energía se termina precipitando en el núcleo. [1] Según la física clásica, la mecánica y el electromagnetismo, un átomo planetario no sería estable durante más de una fracción muy pequeña de un segundo. Con todo, y a sabiendas de esta dificultad insalvable desde el punto de vista clásico, la idea de un átomo planetario era muy atractiva.
La comunidad física continuó buscando un modelo que incluyese una estructura planetaria estable y que, entre otras cosas, pudiese explicar los espectros de emisión de los elementos. Niels Bohr, entonces un físico danés desconocido que acababa de recibir su doctorado, logró construir un modelo muy interesante en 1912-1913. Este modelo se conoce como modelo de Bohr o modelo cuántico del átomo [4], porque incorporó con éxito la idea cuántica de Einstein y Planck. Fue ampliamente reconocido como una gran victoria. Aunque tuvo que modificarse más tarde para tener en cuenta muchos más fenómenos, mostró cómo atacar problemas atómicos mediante el uso de la teoría cuántica. Dado que Bohr incorporó la idea de átomo nuclear de Rutherford, algo crucial para el modelo, el nombre más apropiado para éste quizás sería modelo de Rutherford-Bohr.
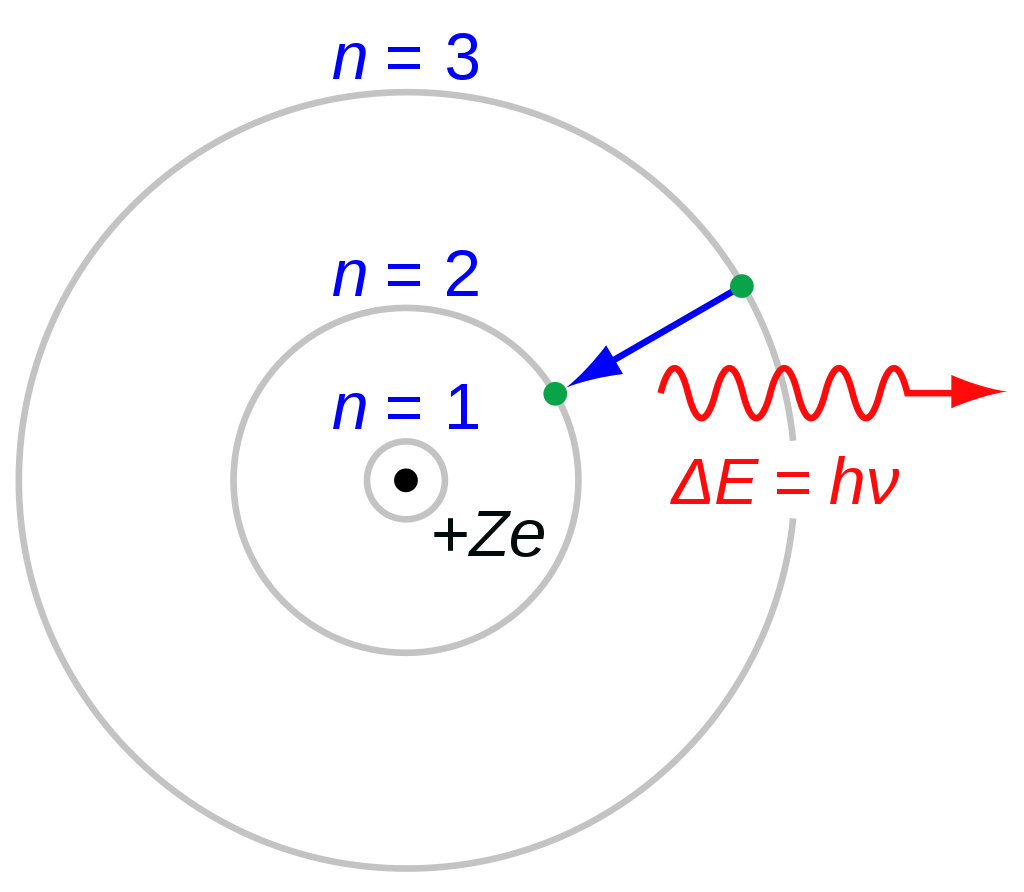
Bohr introdujo dos nuevos postulados [5] específicamente para explicar la existencia de órbitas de electrones estables y espectros de emisión diferentes para cada elemento. Estos postulados pueden expresarse de la siguiente manera:
1. Contrariamente a las predicciones de la física clásica, que después de todo había sido probada solo para circunstancias relativamente a gran escala, existen estados para un sistema atómico en el que no se emite radiación electromagnética a pesar de la aceleración de las partículas cargadas (electrones) . Estos estados se denominan estados estacionarios del átomo.
2. Cualquier emisión o absorción de radiación, ya sea como luz visible u otra radiación electromagnética, corresponde a una transición repentina de la carga entre dos de estos estados estacionarios. La radiación emitida o absorbida tiene una frecuencia f determinada por la relación hf = Ei – Ef (en esta ecuación h es la constante de Planck, y Ei y Ef son las energías del átomo en los estados estacionarios inicial y final, respectivamente.
La teoría cuántica había comenzado con la idea de Planck de que los átomos emiten luz solo en cantidades definidas de energía. Este concepto fue ampliado por la idea de Einstein de que la luz viaja solo como paquetes definidos, cuantos, de energía. Ahora se extendía aún más por lel postulado de Bohr de que los átomos existen en un estado estable solo en estados de energía definidos y «cuantizados». Pero Bohr también usó el concepto cuántico para decidir cuál de todos los estados estacionarios concebibles son realmente posibles. Veremos un ejemplo en la siguiente entrega de la serie.
Notas:
[1] La imagen del sistema planetario atómico es parte del desarrollo histórico del modelo. Debemos recordar que los átomos NO son sistemas planetarios de la misma forma que no son pudin de pasas.
[2] Este es el modelo newtoniano. Sabemos desde la aparición de la relatividad general que esto es solo una aproximación válida matemáticamente.
[3] Parecido a lo que le ocurre a un satélite artificial, que pierde energía debido a la fricción en la atmósfera superior, y gradualmente se mueve en espiral hacia la Tierra. Caería si no se corrigiese su trayectoria con propulsores.
[4] Se lo conoce así pero, en realidad, el modelo de Bohr es el quinto modelo cuántico construido. Más sobre ello en este vídeo.
[5] Son postulados porque se postulan, es decir, al asumir que son ciertos el modelo arroja resultados coherentes con los datos experimentales. No hay otro razonamiento más que este.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Manuel Augusto Bono
Me deja con la miel en la boca. ¿Para cuando la segunda entrega?
Hitos en la red #284 – Naukas
[…] Los postulados de Bohr […]
El tamaño del átomo de hidrógeno — Cuaderno de Cultura Científica
[…] duda, una prueba de fuego para el modelo de Bohr tendría que ser explicar los espectros de los elementos, empezando por el del hidrógeno. Pero […]
La energía del estado estacionario — Cuaderno de Cultura Científica
[…] sabemos, armado solo con sus dos postulados, Bohr podía calcular el radio de cada órbita permitida. No solo eso, además podía calcular la […]
La realidad de los estados estacionarios — Cuaderno de Cultura Científica
[…] realmente los estados estacionarios?[1]¿Podrían los experimentos mostrar directamente que los átomos solo tienen ciertos estados de […]
El modelo de Bohr explica la fórmula de Balmer — Cuaderno de Cultura Científica
[…] el segundo postulado de Bohr, la radiación emitida o absorbida en una transición en un átomo debe tener una frecuencia […]
El modelo de Bohr-Sommerfeld y las propiedades químicas de los elementos — Cuaderno de Cultura Científica
[…] el modelo de Bohr (1913) los átomos de los diferentes elementos difieren en la carga y la masa de sus núcleos y en […]
Las limitaciones del modelo de Bohr — Cuaderno de Cultura Científica
[…] necesario que cualquier nuevo modelo de la estructura atómica aún tendría que explicar la existencia de estados estacionarios. Por lo tanto, un nuevo modelo tendría que basarse en conceptos cuánticos […]
Las ondas electrónicas y la estructura atómica — Cuaderno de Cultura Científica
[…] Bohr había postulado que la cantidad mvr, que llamaremos «momento angular» [1] del electrón que orbita en el átomo de hidrógeno, donde r es el radio de la órbita del electrón, m es la masa de los electrones y v es su velocidad lineal [2], puede tener solo ciertos valores cuantizados. Estos valores cuantizados permiten definir los estados estacionarios. […]
Juntando semiconductores: LEDs y rectificadores — Cuaderno de Cultura Científica
[…] un electrón de conducción en un diodo n-p cae dentro de un hueco, emitirá el exceso de energía en forma de fotón, como lo haría un electrón en un átomo cuando salta a un estado cuántico más bajo. Si […]
Según las matemáticas, el movimiento es imposible. Entonces, ¿cómo nos movemos? – El portal del Homo Sapiens
[…] https://culturacientifica.com/2019/10/01/los-postulados-de-bohr/ […]
Einstein y Niels Bohr — Cuaderno de Cultura Científica
[…] de hidrógeno cuántico viable: incluyendo un núcleo, el recientemente descubierto electrón y el concepto de estado estacionario. El modelo del átomo de Bohr se basaba en el modelo estrictamente clásico de Ernest Rutherford al […]