
¿Cómo llega Rutherford a la conclusión de que el átomo debía tener una concentración de masa y carga, esto es, un núcleo a partir de los primeros experimentos de Geiger y Marsden? Veámoslo con algo más de detalle partiendo de la base de que el modelo imperante en ese momento es el modelo atómico de Thomson.
Lo primero que parecía evidente es que debía existir algo (los núcleos) que tenía que ser mucho más densos que cualquier cosa en los átomos de Thomson. Simplemente, porque una partícula α que se mueve directamente hacia uno de ellos se ve detenida y devuelta. Una analogía sería que una pelota de tenis rebota si impacta con una roca, pero no si lo que se encuentra delante es una nube de partículas de polvo de la misma masa que esa misma roca.

El esquema de la Figura 1 se basa en uno de los diagramas de Rutherford en su artículo de 1911 [1], que sentó las bases de la teoría moderna de la estructura atómica. Muestra dos partículas α cargadas positivamente, A y A’. La partícula α A se dirige directamente hacia un núcleo masivo N. Si el núcleo tiene una carga eléctrica positiva, repelerá la partícula α, que tiene carga positiva. Debido a esta fuerza eléctrica repulsiva, A frenará hasta detenerse a cierta distancia r de N y luego cambiará el sentido de su movimiento, volverá hacia atrás. A’ es una partícula α que no se dirige directamente hacia el núcleo N. Es rechazada por N de tal forma que sigue una trayectoria que se puede demostrar matemáticamente que debe ser una hipérbola. La desviación de A’ de su trayectoria original está indicada por el ángulo ϕ.
Rutherford consideró los efectos en la trayectoria de la partícula α de las variables importantes: la velocidad de la partícula, el grosor de la lámina y la cantidad de carga Q en cada núcleo. Según el modelo de Rutherford, la mayoría de las partículas deberían dispersarse en ángulos pequeños, porque la posibilidad de acercarse a un núcleo muy pequeño directamente es muy pequeña. Pero un número significativo de partículas α debería dispersarse en ángulos grandes. Eran necesarios nuevos experimentos.
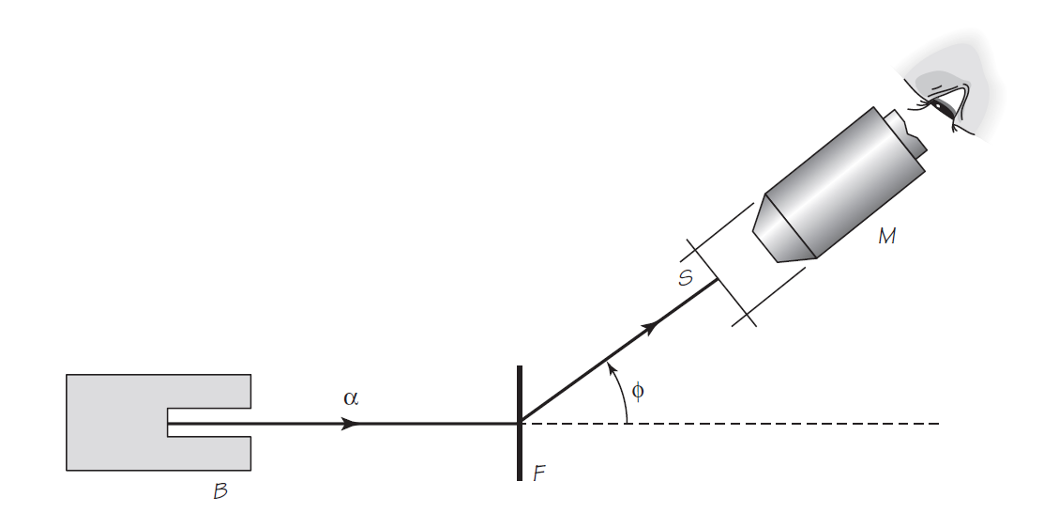
Geiger y Marsden comprobaron [2] estas predicciones con el dispositivo esquematizado en la Figura 2. La caja de plomo B contiene una sustancia radiactiva (radón) que emite partículas α. Las partículas que emergen del pequeño orificio en la caja se desvían en diversos ángulos al pasar pasan a través de una fina capa de metal F. El número de partículas desviadas en cada ángulo ϕ se encuentra dejando que las partículas golpeen una pantalla de sulfuro de zinc S. Cada partícula que golpea la pantalla produce un centelleo (un punto de fluorescencia momentáneo). Estos centelleos se pueden observar y contar mirando a través del microscopio M. El microscopio y la pantalla se pueden mover conjuntamente a lo largo de toda la circunferencia, cubriendo de esta manera todos los ángulos ϕ.
Geiger y Marsden descubrieron que el número de partículas α contadas dependía del ángulo ϕ de dispersión, de la velocidad de las partículas y del grosor de la lámina. Estos hallazgos coincidieron con las predicciones de Rutherford y respaldaron un nuevo modelo atómico, en el cual la mayor parte de la masa y toda la carga positiva ocupan una región muy pequeña en el centro del átomo.[3][4]
Notas:
[1] E. Rutherford (1911) «The Scattering of α and β Particles by Matter and the Structure of the Atom», Philosophical Magazine. Series 6, vol. 21.
[2] H. Geiger, Hans & E. Marsden (1913). «The Laws of Deflexion of α Particles through Large Angles», Philosophical Magazine. Series 6. vol. 25
[3] Lo que implica que la mayor parte del átomo es espacio vacío.
[4] Curiosamente y desde el punto de vista electrostático el átomo de Rutherford es un caso particular del átomo de Thomson. Esto permitió que el primer modelo cuántico del átomo se desarrollase basándose en el modelo de Thomson. Lo hizo Arthur E. Hass en 1910. Esta historia, bastante desconocida, la conté en este video.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
La carga del núcleo y el sistema de periodos — Cuaderno de Cultura Científica
[…] pesar del éxito del modelo atómico de Rutherford a la hora de explicar los resultados de los experimentos de dispersión de partículas α, seguía […]
La carga del núcleo y el sistema de periodos – Fluceando
[…] pesar del éxito del modelo atómico de Rutherford a la hora de explicar los resultados de los experimentos de dispersión de partículas α, seguía […]
Tres modelos atómicos de los que no has oído hablar — Cuaderno de Cultura Científica
[…] experimental al modelo de Nagaoka. En el artículo de 1911 en el que Rutherford presentaría su famoso modelo en el que se propone la existencia del núcleo atómico cita a Nagaoka. Pero en 1908 el propio […]
Einstein y Niels Bohr — Cuaderno de Cultura Científica
[…] electrón y el concepto de estado estacionario. El modelo del átomo de Bohr se basaba en el modelo estrictamente clásico de Ernest Rutherford al que el físico danés añadió la nueva idea de que la energía no era continua, sino que venía […]