
Maxwell exploró los límites de una concepción estadística de la segunda ley mediante un «experimento mental» interesante. Supongamos que un recipiente de gas se divide por una membrana delgada en dos partes, el gas en una parte está más caliente que en la otra. «Ahora concibe un ser finito», sugirió Maxwell, «que conoce las trayectorias y las velocidades de todas las moléculas, pero que no puede hacer otro trabajo que no sea abrir y cerrar un agujero en el diafragma». Este «ser finito», ahora conocido como el «demonio de Maxwell» puede calentar el gas caliente y enfriar el gas frío, permitiendo que las moléculas rápidas se muevan en una sola dirección a través del orificio (y las moléculas lentas en la otra), como se muestra en el diagrama, en el que, convencionalmente, el rojo representa moléculas de alta velocidad (y energía) y las azules de baja velocidad (y energía).
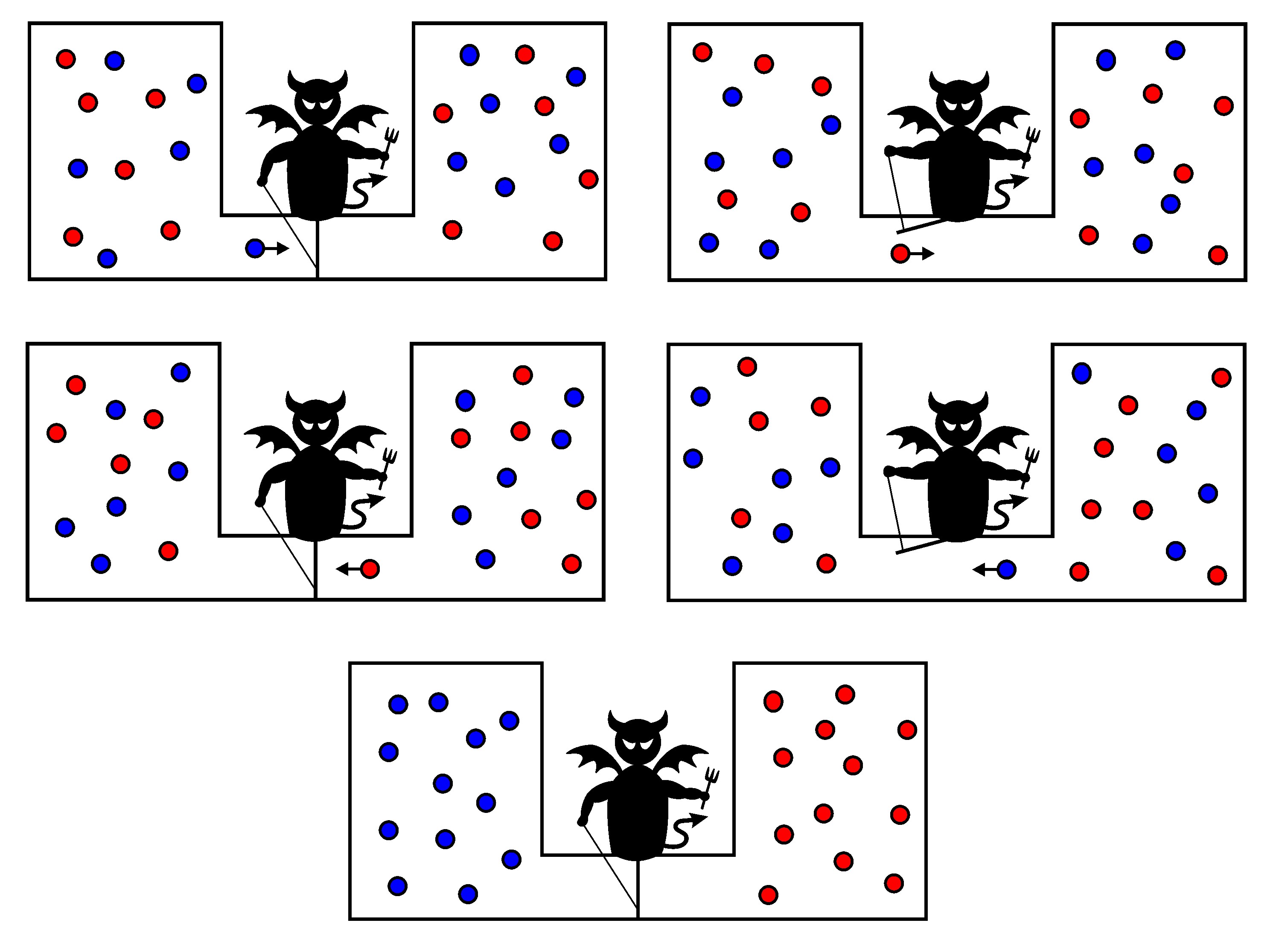
Por supuesto, no existe un demonio tan fantasioso (ni siquiera en forma de máquina) que pueda observar y seguir todas y cada una de las moléculas en un gas; por lo tanto, no existe ningún procedimiento como este para violar la segunda ley que puede realizarse en la práctica. De hecho, si de alguna manera se pudiera construir un «demonio», podríamos encontrar que la propia entropía del demonio (que sería en sí mismo un sistema) se ve afectada por sus acciones. Así, su entropía podría aumentar lo suficiente como para compensar la disminución de la entropía del gas, con lo que la entropía neta aumenta, como dicta la segunda ley.
Esto es exactamente lo que sucede en otros sistemas donde se crea orden local, como en una bandeja de agua que se congela en cubos de hielo en un congelador; la entropía debe aumentar en algún otro lugar del universo, como en la habitación en la que está el congelador, donde se disipa el calor residual del motor del congelador.
Hay quien ha sugerido que ciertas moléculas grandes, como las enzimas, pueden funcionar como «demonios de Maxwell». Las moléculas grandes pueden influir en los movimientos de las moléculas más pequeñas para construir las estructuras ordenadas de los sistemas vivos. Esto es algo que no ocurre en los objetos inanimados y sería una aparente violación de la segunda ley de la termodinámica. Esta sugerencia, sin embargo, lo que demuestra es que no se ha entendido un aspecto fundamental de la segunda ley.
Efectivamente, la segunda ley no dice que el orden no pueda aumentar nunca en un sistema. Hace esa afirmación solo para sistemas aislados. Cualquier sistema «no aislado», que pueda intercambiar energía con su entorno, puede aumentar su propio orden sin violar la segunda ley, ya que la entropía del entorno aumentará, compensando la disminución en el sistema abierto y aumentando la entropía del universo. Exactamente igual que un congelador, que es un sistema cerrado pero no aislado.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

The Demon in the Machine (Paul Davies) – Más o menos
[…] un lado destaca como la vida se basa en un funcionamiento parecido al «demonio de Maxwell«. Esta es un experimento mental que planteó en 1867 el gran físico J.C Maxwell donde un ser […]
Tenet | Cine Divergente
[…] científico César Tomé López explica esta teoría en El demonio de Maxwell. Recuperado de https://culturacientifica.com/2017/10/24/el-demonio-de-maxwell/ […]
Ramiro Augusto Salazar La Rotta
La gravedad es el mismo demonio de Maxwell, si mezclas dos líquidos inmiscibles de diferentes densidades en un recipiente cerrado transparente y aislado termicamente luego de al cabo de un tiempo se ordenara espontáneamente por densidad, disminuyendo la entropia de la mezcla. Igual pasa lo mismo si mezclas dos gases no miscibles de diferente densidad en un recipiente transparente cerrado y aislado con el paso del tiempo y sin agitación estando en reposo se ordenara por si mismo en dos capas la primera capa el gas mas pesado y la capa de arriba contendrá el gas mas liviano, también reduciendo la entropia con el tiempo comparada con la entropia inicial que tenia la mezcla desordenada.
César Tomé
Tanto como la gravedad… en los ejemplos asumes que el sistema está en unas condiciones de temperatura y presión compatibles con una laguna de miscibilidad. Por lo tanto si existe una mezcla inicial eso significa que el sistema está al inicio fuera de las condiciones de la laguna de miscibilidad, por ejemplo a una temperatura superior a la temperatura crítica de disolución. Si el sistema está aislado, no hay bajada de la temperatura y los líquidos permanecen mezclados. Si, por otra parte, el sistema está en las condiciones de la laguna de miscibilidad todo el rato, eso significa que los líquidos ya formaban dos fases y que hemos tenido que agitar para mezclar, pero agitar supone introducir energía en el sistema y entonces no es aislado.
Cómo puede la IA ahorrar energía usando ordenadores reversibles
[…] campo del procesamiento de la información. Un tema central de su trabajo fue la relación entre la entropía, que es una medida del desorden, y la […]