El sistema de periodos

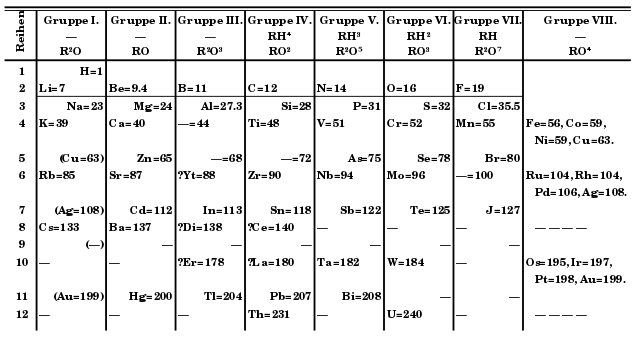
En 1869 un químico llamado Dmitri Ivanóvich Mendeléyev dispuso los 63 elementos entonces conocidos en filas según sus propiedades químicas, construyendo columnas conforme aumentaban los pesos atómicos [1]. Encontró que cuando se organizaban de esta manera aparecía una periodicidad. Llamó a su trabajo “Un experimento sobre un sistema de elementos basado en sus pesos atómicos y sus similitudes químicas”. Aunque faltaban algunos elementos para que todo cuadrase, Mendeléyev asumió correctamente que eran elementos aun por descubrir y dejó no solo un espacio para ellos sino una previsión de sus propiedades químicas en función de la periodicidad que les correspondía por su posición. El hallazgo posterior de estos elementos confirmaría la hipótesis periódica. Había sido descubierto el sistema de periodos [2].
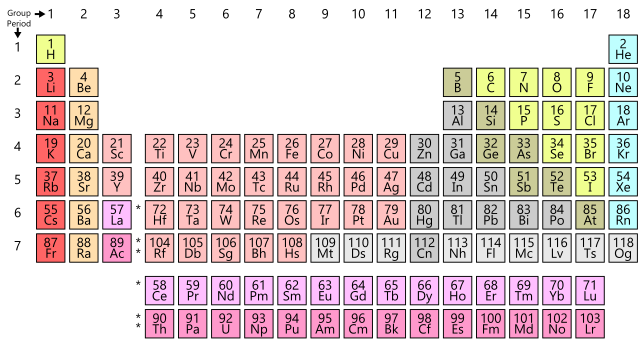
Los elementos dispuestos en una tabla periódica moderna que se encuentran uno debajo del otro en cada columna o grupo comparten propiedades químicas y físicas en un grado notable, como Mendeléyev había descubierto. Por lo tanto, se puede considerar que estos elementos pertenecen a la misma «familia» de elementos. Por ejemplo, el grupo 1 contiene la familia de los metales alcalinos: litio, sodio, potasio, rubidio, cesio y francio [4]. Este es un grupo de metales blandos con densidades muy bajas, puntos de fusión bajos y comportamiento químico similar. Otra familia de elementos, llamados halógenos, se encuentra en el grupo 17: flúor, cloro, bromo, yodo, astato [5]. Estos elementos se combinan violentamente con muchos metales y forman sales cristalinas blancas (halógeno significa «formador de sal»). Estas sales tienen fórmulas similares, como NaF, NaCl, NaBr, MgCl2, MgBr2, etc.
Ocasionalmente, por razones entonces desconocidas, era necesario apartarse del esquema general de ordenamiento de los elementos. Por ejemplo, las propiedades químicas del argón (Ar) y del potasio (K) exigen que se coloquen en las posiciones dieciocho y diecinueve para que se encuentren en grupos característicos por sus propiedades químicas. Sobre la base de sus masas atómicas solamente (39,948 u para argón; 39,102 u para potasio) sus posiciones tendrían que estar invertidas.
La regularidad, simetría y capacidad predictiva del sistema de periodos son indicios de que el modelo que explique la estructura de los átomos de los distintos elementos posee también estas características. Ese modelo surgiría a lo largo de la primera mitad del siglo XX, y no defraudó. Veremos la gran cantidad de ingenio y trabajo detectivesco que fue necesario para comprender la estructura de los átomos y como, de ella, surge la periodicidad de los elementos que podemos observar.
Notas:
[1] ¡Atención! ¡Esto es diferente a las tablas periódicas actuales!
[2] Por mucho que este año se celebre el 150 aniversario de “la tabla periódica” lo correcto es decir que se celebra el 150 aniversario del sistema de periodos. La tabla periódica tal y como la solemos utilzar es un diseño químico-físico establecido por Werner y perfeccionado por Paneth en los años cuarenta del siglo XX. Hay muchos diseños, pero en lo sucesivo tabla periódica moderna significará tabla Werner-Paneth
[3] En esto coincide con las tablas periódicas modernas.
[4] ¿Es el hidrógeno un metal?¿Qué hace ahí? Lo descubriremos avanzada esta serie.
[5] Las propiedades químicas del teneso (Ts) aún no son bien conocidas pero puede que se aparten algo de las típicas de los halógenos. De hecho el astato se parece químicamente al yodo pero es significativamente más metálico. Ya iremos descubriendo por qué.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
El concepto de estructura atómica — Cuaderno de Cultura Científica
[…] al hablar del sistema de periodos que su regularidad, simetría y capacidad predictiva son indicios de que el modelo que explique la […]
El concepto de estructura atómica – Fluceando
[…] al hablar del sistema de periodos que su regularidad, simetría y capacidad predictiva son indicios de que el modelo que explique la […]
La estructura de la tabla periódica se deduce de la estructura de capas de los átomos – Judith Chao Andrade
[…] para cada nuevo metal alcalino en el Grupo 1 de la tabla periódica de Werner-Paneth, se inicia una nueva capa. Cada átomo de metal alcalino tiene un solo electrón alrededor de un […]
Un catálogo de estructuras magnéticas topológicas — Cuaderno de Cultura Científica
[…] sistema de periodos original ordenaba los elementos químicos por sus propiedades químicas. Esta clasificación en su día […]