Las partículas de los rayos catódicos
Decíamos que en 1897 J.J. Thomson, jefe del famoso Laboratorio Cavendish en la Universidad de Cambridge, realizó una serie de experimentos que convencieron a los físicos de que los rayos catódicos son partículas cargadas negativamente.
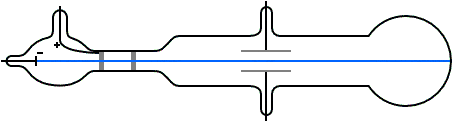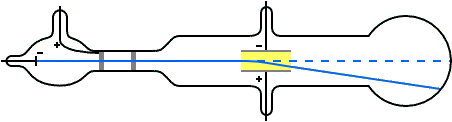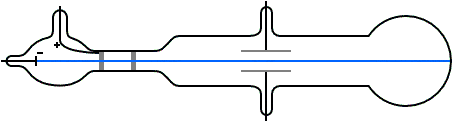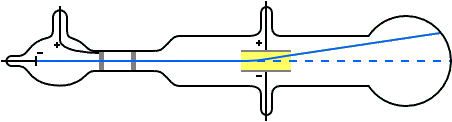
Para entonces era bien sabido que las trayectorias de las partículas cargadas se ven afectadas tanto por los campos magnéticos como por los eléctricos. Suponiendo que los rayos catódicos eran partículas cargadas negativamente, Thomson podía predecir qué sucedería cuando atravesasen estos campos. Por ejemplo, un campo eléctrico de la magnitud y dirección correctas debería equilibrar exactamente la desviación producida en un haz de rayos catódicos por un campo magnético. Thomson pudo comprobar que las predicciones eran correctas. De aquí, por tanto, pudo concluir que los rayos catódicos estaban hechos de partículas cargadas negativamente.
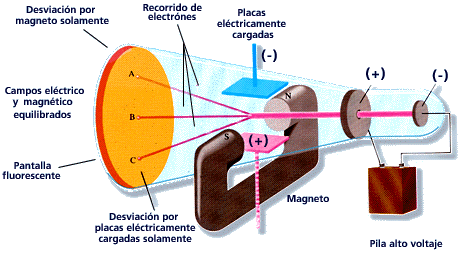
A partir de los datos experimentales podía calcular la relación entre la carga de una partícula y su masa. Esta relación la podemos representar como q / m, donde q es la carga y m es la masa de la partícula. Thomson descubrió que los rayos provenientes de cátodos hechos de diferentes materiales tenían el mismo valor de q / m: 1,76·1011 C / kg (culombios por kilo). Por lo tanto, estaba claro que los rayos catódicos debían estar hechos de algo que todos los materiales tienen en común.
El valor de q / m para las partículas de rayos catódicos resultó ser aproximadamente 1800 veces mayor que el valor de q / m para los átomos de hidrógeno cargados (iones), que se sabía que era 9,6 ·107 C / kg por experimentos de electrólisis química . De aquí se deducía que o la carga de las partículas de rayos catódicos es mucho mayor que la del ion de hidrógeno, o que la masa de las partículas de rayos catódicos es mucho menor que la masa del ion de hidrógeno.
Para decidir entre las dos posibilidades Thomson también midió la carga q en las partículas con carga negativa en los rayos catódicos con métodos distintos a la desviación por campos eléctricos y magnéticos. Sus experimentos no fueron muy precisos, pero fueron lo suficientemente buenos como para indicar que la magnitud de la carga negativa de una partícula de rayos catódicos era la misma o no muy diferente de la magnitud de la carga del ion hidrógeno positivo en la electrólisis. En vista del gran valor de q / m para las partículas de rayos catódicos, Thomson concluyó que la masa m de las partículas de rayos catódicos es mucho menor que la masa de iones de hidrógeno.
En resumen Thomson había descubierto que las partículas de rayos catódicos tienen tres propiedades importantes:
1. Los mismos tipos de partículas se emitiden por una amplia variedad de cátodos de diferentes materiales.
2. Eran mucho más pequeñas en masa que el átomo de hidrógeno, el átomo que tiene la masa más pequeña.
3. Tenían la misma magnitud de carga que la carga en el ion de hidrógeno.
A la vista de estos hechos Thomson no podía sino concluir que las partículas de rayos catódicos deben ser un componente hasta ahora no observado de toda la materia [1]. Dado que transporta carga eléctrica, la partícula de rayos catódicos se identificaría con un nombre inventado mucho antes, electrón. Tiene una carga negativa de -1,6·10-19 C. La magnitud [2] de la carga de electrones recibe el símbolo e, donde e =1,6·10-19 C.
El hallazgo de Thomson significó que el átomo no era el límite máximo para la subdivisión de la materia. Más bien, el electrón parecía ser parte de ciertos átomos, quizás incluso podría ser un componente básico de todos los átomos. [3]
Notas:
[1] Puedes deducir con estos datos que es parte de la materia, no parte de los átomos, ya que con el conocimiento de la época nada impedía que los electrones fuesen algo independiente de los átomos.
[2] La magnitud no incluye el signo.
[3]El electrón, cuya existencia Thomson probó por primera vez mediante un experimento cuantitativo, es una de las partículas fundamentales o «elementales» de las que está hecha toda la materia. ¿Pero cómo sabemos que es elemental y que es constituyente de todos los átomos?
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
Hitos en la red #270 – Fluceando
[…] Las partículas de los rayos catódicos […]
El modelo atómico de Thomson — Cuaderno de Cultura Científica
[…] al hablar de los electrones como las partículas de los rayos catódicos que los átomos de hidrógeno tienen unas 1800 veces más masa que los electrones, que tienen una […]
El modelo atómico de Thomson – Fluceando
[…] al hablar de los electrones como las partículas de los rayos catódicos que los átomos de hidrógeno tienen unas 1800 veces más masa que los electrones, que tienen una […]
El desconcertante efecto fotoeléctrico — Cuaderno de Cultura Científica
[…] de la relación q / m para estas partículas. Utilizando el mismo método que había usado para las partículas de los rayos catódicos Thomson obtuvo el mismo valor para las partículas fotoeléctricas que para las partículas de los […]
Estos 10 inventos fueron un inesperado accidente | REC Magazine |
[…] Wilhelm Roentgen descubrió que podía ver sus huesos en una pantalla cuando encendía un tubo de rayos catódicos y el cuarto estaba completamente oscuro. Reemplazó el tubo con una placa fotográfica para […]
La composición del átomo – Escuela Ciencias
[…] partícula cargada negativamente. En 1897 Joseph John Thomson, realizando experimentos con el CRT, hizo el descubrimiento de una partícula que forma parte del átomo y que confirma la hipótesis […]