Presión y volumen de un gas

Terminábamos la entrega anterior preguntándonos por qué las bombas de pistón manuales, también llamadas bombas de elevación o aspirantes, no pueden elevar el agua más de 10 metros y cuestionándonos por qué funcionaban. Estas preguntas se resolvieron a lo largo del siglo XVII gracias al trabajo experimental de varios investigadores, entre ellos, Torricelli (un alumno de Galileo), Guericke, Pascal, y Boyle.
Para 1660, estaba bastante claro que el funcionamiento de una bomba de aspirante depende de la presión del aire. Al eliminar un poco de aire por encima del agua por la acción de la bomba, simplemente se reduce la presión en la parte superior del agua que está dentro del tubo sumergido en el pozo. Como inicialmente la presión es la atmosférica, eso quiere decir que la acción de la bomba consigue que ahora haya una presión inferior a la atmosférica por encima de la columna de agua que está en el tubo. Es entonces la presión que ejerce la atmósfera en la masa de agua del pozo la que fuerza a que el agua suba por el tubo hasta que se igualan las presiones (la presión dentro del tubo es ahora la de la columna de agua que está por encima del nivel de la superficie del agua del pozo más lo que quede de presión atmosférica). Una buena bomba puede reducir la presión en la parte superior del tubo a casi cero. La presión atmosférica puede, por tanto, forzar el agua del tubo a elevarse considerablemente por encima del nivel del agua del pozo.
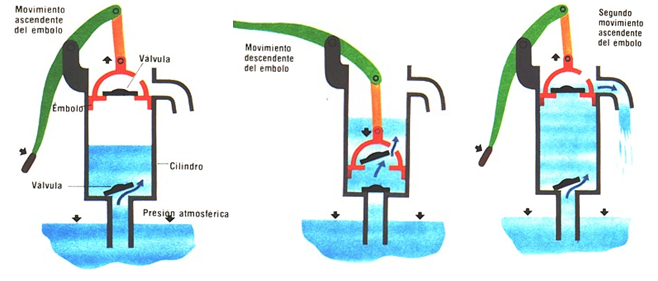
Pero ocurre que la presión atmosférica al nivel del mar no es lo suficientemente grande como para soportar una columna de agua de más de 10 m de altura. Como el mercurio es casi 14 veces más denso que el agua, la misma presión atmosférica solo podría soportar una columna 14 veces más pequeña, esto es, de aproximadamente 0.76 m (760 mm). Resulta que esta altura está muy bien para construir un instrumento con el que medir la presión atmosférica.

Por lo tanto, gran parte de la investigación del siglo XVII sobre la presión atmosférica se realizó con una columna de mercurio, un barómetro de mercurio. Torricelli diseñó el primero de estos barómetros. La altura de la columna de mercurio que puede ser soportada por la presión del aire no depende del diámetro del tubo, es decir, no depende de la cantidad total de mercurio, sino sólo de su altura. Esto puede parecer extraño al principio. Para entenderlo, debemos considerar la diferencia que existe entre presión y fuerza. La presión se define como la magnitud de la fuerza (F) que actúa perpendicularmente (esto lo indicamos con el símbolo ┴ como subíndice) sobre una superficie dividida por el área (A) de esa superficie, P = F┴ / A , y se mide, por tanto, en N/m2.

Por lo tanto, una fuerza grande puede producir una presión pequeña si se distribuye por un área muy grande. Por ejemplo, se puede caminar sobre la nieve sin hundirse en ella si se emplean raquetas de nieve Por otra parte, una pequeña fuerza puede producir una gran presión si se concentra en un área pequeña. El tacón de los zapatos de tacón de aguja puede producir una presión enorme, mayor que la hay debajo de la pata de un elefante; de hecho, pueden perforar suelos de madera y alfombras con mucha facilidad.
En definitiva, la medida de la presión no se ve afectada por el área de la sección transversal del tubo del barómetro ni por el peso (que es una fuerza) de la masa de mercurio en la columna, porque la presión es precisamente el cociente entre las dos. En una columna de mercurio que pese el doble que otra porque el tubo sea el doble habrá la misma presión porque el área será también el doble.
Este tipo de variables que no dependen de la masa se llaman intensivas. Existe otro tipo de variables, las llamadas extensivas que si dependen de la cantidad de materia, como el volumen. Pero sabemos que si aumentamos la presión, por ejemplo soplando más en un globo, el volumen puede aumentar. Es muy interesante esta relación de propiedades intensivas y extensivas.
En 1661, dos científicos ingleses, Richard Towneley y Henry Power, descubrieron una importante relación básica. Encontraron que en un globo de paredes delgadas, la presión ejercida por un gas es inversamente proporcional al volumen ocupado por ese gas. Duplicar la presión (al dejar entrar más gas) duplicará el volumen del globo. Usando P para la presión y V para el volumen, esta relación es P = a /V, donde a es una constante de proporcionalidad; también lo podemos escribir, P·V = a .

Si el volumen de una cantidad dada de aire en un globo es reducido a la mitad (por ejemplo, comprimiéndolo), la presión ejercida por el gas en el interior se duplica. Por otro lado, si se dobla el volumen del recipiente cerrado con una cierta cantidad de aire dentro, la presión interior se reduce a la mitad. Robert Boyle confirmó esta relación mediante multitud de experimentos. Es una regla empírica, ahora generalmente conocida como la ley de Boyle. Sin embargo, la ley se aplica exactamente sólo bajo condiciones especiales, como veremos.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Hitos en la red #178 – Naukas
[…] Presión y volumen de un gas […]
gabriela
Siempre he tenido la duda de cómo logra llegar la savia a la copa de una secuoya…