La ley del gas ideal y la tercera ley de la termodinámica
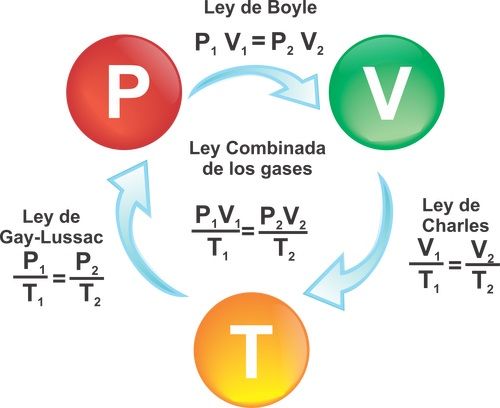
Boyle se dio cuenta de que si la temperatura de un gas cambia durante un experimento, la relación P = a/V ya no es correcta. Por ejemplo, la presión ejercida por un gas en un recipiente cerrado de tamaño fijo aumenta si el gas se calienta, aunque su volumen permanece constante. Sin embargo, si la temperatura de un gas se mantiene constante, entonces la regla de Boyle sí funciona. Así, modificamos la regla de la siguiente manera:
P = a/V, si T es constante (a)
Muchos científicos a lo largo del siglo XVIII también investigaron cómo, por ejemplo en un globo de paredes delgadas, los gases se expanden cuando se aporta calor, a pesar de que la presión sigue siendo la misma. Finalmente, se acumularon suficientes indicios como para formular una regla general sorprendentemente simple. El químico francés Joseph-Louis Gay-Lussac (1778-1850) encontró que todos los gases que estudió (aire, oxígeno, hidrógeno, dióxido de carbono, etc.) cambian su volumen de la misma manera. Si la presión se mantenía constante, entonces el cambio de volumen era proporcional al cambio de temperatura. Esto puede expresarse en símbolos:
ΔV ∝ ΔT, si P es constante (b)
Por otra parte, si el volumen se mantenía constante (usando, por ejemplo, un contenedor rígido), el cambio en la presión del gas era proporcional al cambio de la temperatura:
ΔP ∝ ΔT, si V es constante (c)
Los datos experimentales obtenidos por Boyle, Gay-Lussac y muchos otros científicos se expresan en las tres proporcionalidades, (a), (b) y (c). Éstas relacionan las tres características principales de una cantidad fija de un gas: la presión, el volumen y la temperatura, medidos cada uno desde cero, cuando una variable se mantiene constante. Introduciendo una nueva constante, k, estas tres proporcionalidades pueden unirse en una sola ecuación general conocida como ley del gas ideal.
P·V = k·T
Esta ecuación es uno de los descubrimientos más importantes sobre los gases, pero al usarla se debe tener un cuidado extremo con las unidades. La constante de proporcionalidad k depende del tipo de gas (en concreto de su masa molar); T, la temperatura del gas, tiene que ser dada en la escala absoluta, o Kelvin, donde, como ya mencionamos, T (K) = T (° C) + 273,15. La presión P es siempre la presión total (en unidades de N / m2, a la que se da el nombre de Pascal, abreviatura Pa), e incluye la denominada presión ambiente de la atmósfera. Esto es algo que se suele olvidar. Así, si inflo en neumático trasero de mi coche hasta los 2,2 ·105 Pa por encima de la presión atmosférica tal y como indica el fabricante, la presión real dentro del neumático es de 2,2 ·105 Pa + 1,0 ·105 Pa = 3,2 ·105 Pa.
La ecuación que relaciona P, V y T se denomina “ley” del gas ideal porque no es completamente exacta para gases reales a presiones muy bajas. Tampoco se aplica cuando la presión es tan alta, o la temperatura tan baja, que el gas está a punto de pasar a ser líquido. Por lo tanto, no es una ley de la física en el mismo sentido que la majestuosa ley de la conservación de la energía, que es válida en todas las circunstancias.
En realidad es simplemente es un resumen útil aproximado de resultados experimentales de las propiedades observadas de gases reales. No hay más que considerar lo que sucedería si intentamos bajar la temperatura del gas al cero absoluto; Es decir, T = 0 K (o, en Celsius, t = – 273,15 ° C). En este caso extremo, todo el término de la ecuación en el que está la temperatura sería cero. Por tanto, el término PV también debe ser cero. A presión constante, el volumen se reduciría a cero, lo que no tiene sentido si tenemos una cantidad de gas distinta de cero.
De hecho, todos los gases reales se vuelven líquidos antes de alcanzar esa temperatura. Tanto el experimento como la teoría termodinámica indican que es realmente imposible enfriar cualquier cosa -gas, líquido o sólido- exactamente a esta temperatura de T = 0 K. Este hecho se conoce como tercera ley de la termodinámica.
Sin embargo, una serie de operaciones de enfriamiento pueden producir temperaturas que se acercan mucho a este límite. En vista del significado único de la temperatura más baja para un gas que obedece a la ley del gas ideal, Lord Kelvin (William Thomson) propuso la escala de temperatura absoluta y puso su cero a – 273,15 ° C. Esta es la razón por la que la escala absoluta se denomina a veces escala de Kelvin, y por qué las temperaturas en esta escala se miden en kelvins.
La ley del gas ideal, P·V = k·T, es una ley fenomenológica, es decir, resume hechos experimentales sobre gases. La teoría cinética de los gases ofrece una explicación teórica de estos hechos. Para prepararnos para eso, necesitamos desarrollar un modelo cinético de un gas.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Einstein y el condensado de Bose-Einstein — Cuaderno de Cultura Científica
[…] cercanas al cero absoluto. En 1925, Einstein descubrió que si a un gas se le baja la temperatura hasta aproximarla al cero absoluto, una temperatura a la que los átomos casi no se muevan, todos alcanzarán exactamente el mismo […]