La estructura de la tabla periódica se deduce de la estructura de capas de los átomos
Las consideraciones cualitativas sobre el comportamiento químico de los elementos desde el punto de vista del modelo de Bohr-Sommerfeld llevaron a un cuadro consistente en el que los electrones se distribuían en capas alrededor del núcleo atómico, creando una especie de “núcleo compuesto”. Estos “núcleos compuestos” no eran otra cosa que los gases nobles, que tenían una configuración electrónica especialmente estable.
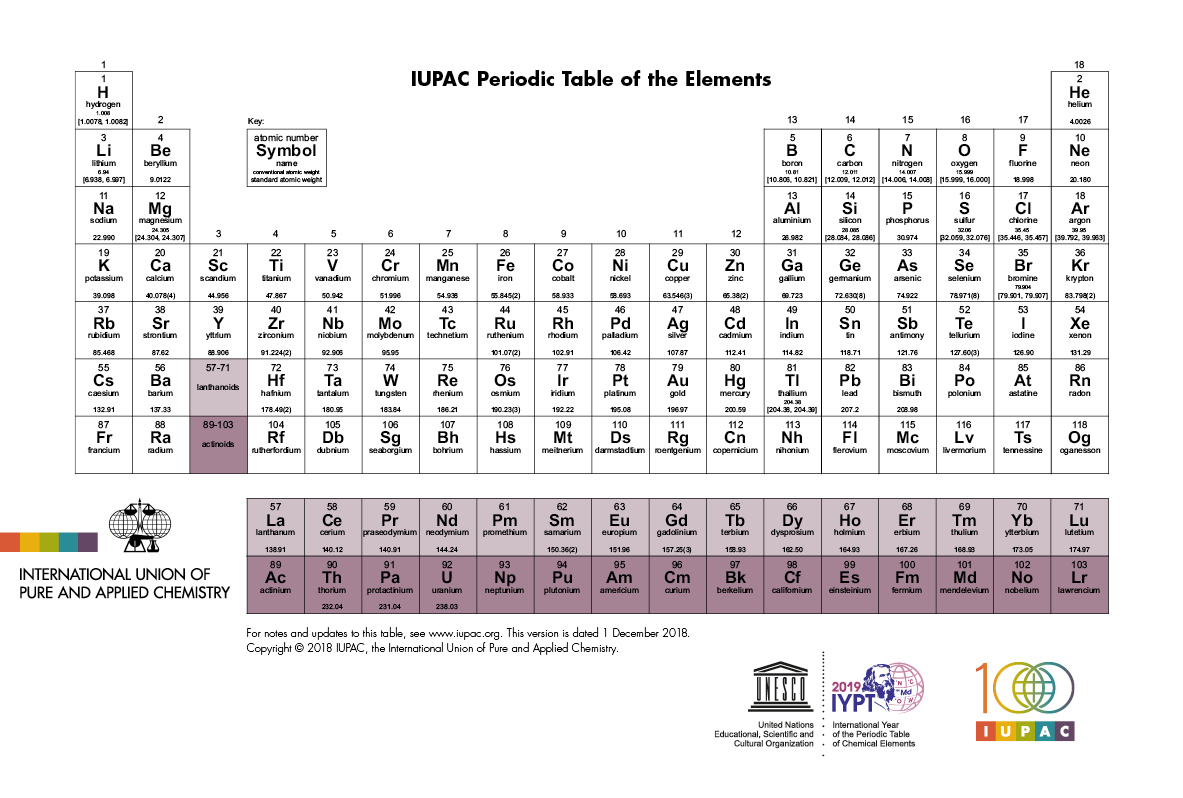
Así, para cada nuevo metal alcalino en el Grupo 1 de la tabla periódica de Werner-Paneth, se inicia una nueva capa. Cada átomo de metal alcalino tiene un solo electrón alrededor de un núcleo compuesto que tiene la estructura del gas noble precedente. Es esperable que este electrón periférico se “pierda” fácilmente por la acción de los átomos vecinos, y esto concuerda con los hechos. Los elementos litio, sodio y potasio son metales alcalinos. Tanto en compuestos como en disolución, están en forma de iones, como Li+, Na+ y K+. Cada ion es un átomo que ha perdido un electrón y, por lo tanto, tiene una carga neta positiva +e. Otra consecuencia es que en los átomos neutros de estos elementos, el electrón externo es relativamente libre de moverse. Esta propiedad se ha utilizado como base de una teoría de la conductividad eléctrica. Según esta teoría, un buen conductor tiene muchos electrones «libres» que pueden formar una corriente en condiciones apropiadas. Un mal conductor pobre tiene relativamente pocos electrones «libres». Los metales alcalinos son todos buenos conductores. Los elementos cuyas capas de electrones están llenas son conductores muy pobres; no tienen electrones «libres».
En el Grupo 2 de la tabla periódica, podemos esperar que los elementos que siguen inmediatamente después de los metales alcalinos tengan átomos con dos electrones periféricos. Por ejemplo, el berilio (Z = 4) debe tener dos electrones en la capa K, llenándola, y dos en la capa L. Si los átomos de todos estos elementos tienen dos electrones periféricos, deberían ser químicamente similares, como lo son realmente. Por lo tanto, el calcio y el magnesio, que pertenecen a este grupo, deberían formar fácilmente iones como Ca++ y Mg++, cada uno con una carga neta positiva de +2e. Esto también se encuentra que es cierto.
Como último ejemplo, consideremos aquellos elementos que preceden inmediatamente a los gases nobles en la tabla periódica, los del grupo 17. Por ejemplo, los átomos de flúor (Z = 9) deberían tener dos electrones llenando la capa K pero solo siete electrones en la capa L, uno menos que de lo necesarioe para llenarla. Si un átomo de flúor captura un electrón adicional, se convertiría en un ion F– con una carga neta negativa. La capa L estaría llena entonces, y sería análoga a la del átomo neutro del gas noble neón (Z = 10), y por este motivo cabe esperar que el ion F sea relativamente estable. Esta predicción concuerda con lo observado. De hecho, todos los elementos que preceden inmediatamente a los gases nobles tienden a formar en disolución iones estables con carga unidad negativa. En estado sólido, es de esperar que estos elementos carezcan de electrones libres. De hecho, todos ellos son malos conductores de electricidad.
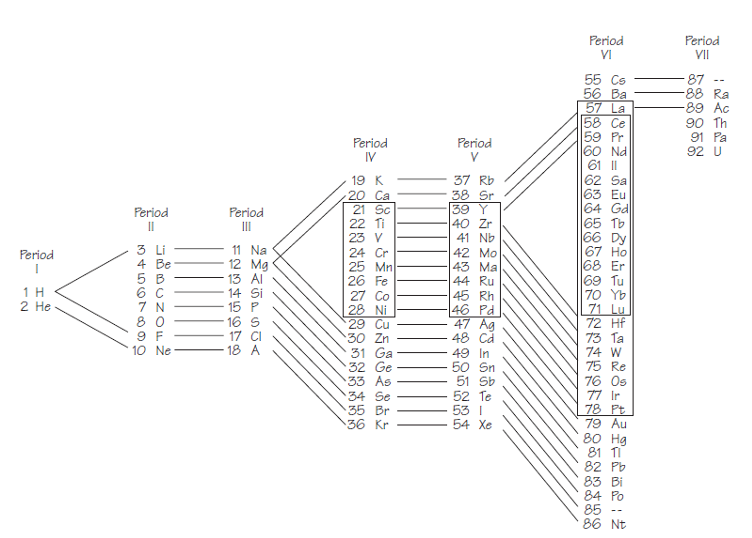
Tal y como se indica en la figura 2, basada en una ilustración de una publicación de Bohr de 1922, las siete capas principales, K, L, M,. . . , Q, se dividen naturalmente en órbitas o subcapas. Las capas se llenan de electrones para minimizar la energía total del átomo. La periodicidad resulta del llenado de las subcapas.
La tabla de Bohr, aún útil, fue un resultado de física teórica y ofreció una base física fundamental para comprender la química: demostró cómo la estructura de la tabla periódica se deduce de la estructura de capas de los átomos.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

Luis
Excelente información gracias publicaciónes como estás me interesam