Otras predicciones del modelo cinético. Movimiento browniano
Nuestro modelo cinético para un gas permite realizar más predicciones cuantitativas interesantes además de la ley del gas ideal.
Sabemos por experiencia (por ejemplo, cuando inflamos una rueda de bicicleta muy rápidamente) que cuando un gas se comprime o condensa rápidamente su temperatura cambia. ¿Cómo explica nuestro modelo este fenómeno?
Tal y como veíamos cuando hablábamos del gas ideal, las moléculas rebotan en todas direcciones entre las paredes del contenedor. Cada una de las colisiones con la pared es perfectamente elástica, por lo que las moléculas rebotan sin pérdida de energía cinética. Supongamos ahora que la fuerza externa que mantiene a la pared en su sitio aumenta de repente. Al comprimir el gas se realiza trabajo sobre las partículas, y como el trabajo no es más que una forma de transferencia de energía, esto se traduce en un aumento de la energía cinética de las partículas. Pero sabemos ya que la temperatura de un gas es proporcional a la energía cinética promedio de sus moléculas, por lo que al comprimir un gas su temperatura sube.
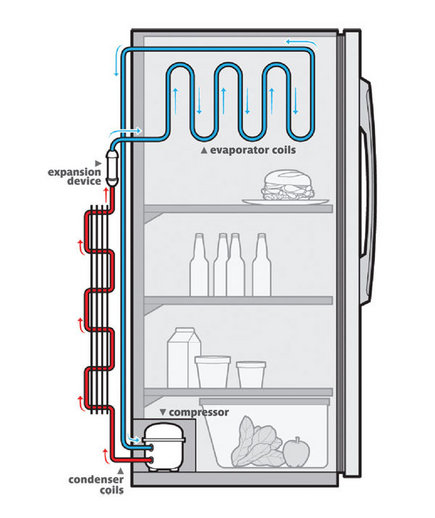
Si, por el contrario, la fuerza externa sobre la pared disminuye en vez de aumentar, ocurre justo al revés. Mientras la pared se mantuvo quieta las partículas no efectuaban trabajo sobre ella y la pared no efectuaba trabajo sobre las partículas. Si la pared tiene ahora libertad para moverse hacia fuera, esto es, en el mismo sentido que la fuerza que ejercen sobre ella por las partículas al chocar, la cosa cambia. Dado que las partículas al colisionar ejercen una fuerza sobre la pared y la pared se mueve en la dirección de la fuerza, podemos afirmar que las partículas están realizando trabajo sobre la pared. La energía necesaria para realizar este trabajo debe venir de alguna parte. La única fuente de energía aquí es la energía cinética de las partículas. Por lo tanto la energía cinética de las partículas debe disminuir, es decir, rebotan con menos velocidad. Esto implica, de forma automática, que la temperatura del gas debe disminuir. Que es exactamente lo que ocurre cuando aumenta el volumen del contenedor de un gas, y es la base del funcionamiento de los sistemas de refrigeración.
Existen muchas pruebas experimentales que apoyan estas conclusiones y, por tanto, apoyan la teoría cinético molecular de los gases y, por extensión, la teoría cinético molecular de la materia en general.
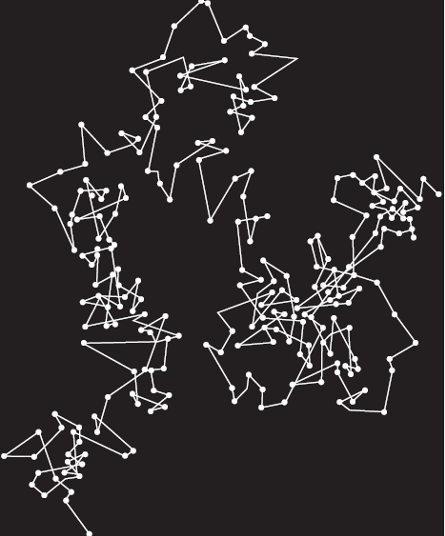
Quizás la prueba definitiva, porque explica cosas que no se podían explicar de ninguna otra manera, es el movimiento de partículas muy pequeñas pero visibles a través de un microscopio, cuando están suspendidas en un gas o líquido. Las moléculas de gas o líquido son demasiado pequeñas para ser vistas directamente, pero sus efectos sobre una partícula más grande (por ejemplo, una partícula de humo o un grano de polen) se pueden observar a través del microscopio.
En cualquier momento, enjambres de moléculas moviéndose a velocidades muy diferentes están golpeando la partícula más grande por todos los lados. Participan tantan moléculas que su efecto total casi se cancela. Eso sí, cualquier efecto neto cambia en magnitud y dirección de un momento a otro. Por lo tanto, el impacto de las moléculas invisibles hace que las partículas visibles parezcan «bailar» aleatoriamente en el campo de visión del microscopio. Cuanto más caliente esté el gas o el líquido (por tanto, con más energía cinética las moléculas), más animado el movimiento.
Esta observación se conoce como movimiento browniano. El nombre hace referencia al botánico inglés, Robert Brown, que en 1827 observó el fenómeno mientras observaba una suspensión de granos microscópicos del polen. El mismo tipo de movimiento de partículas suspendidas («movimiento térmico») existe en líquidos y sólidos, aunque en éstos el movimiento de las partículas está muchísimo más limitado.
El origen del movimiento browniano fue un misterio durante muchos años, hasta que en 1905 Albert Einstein, usando la teoría cinética, predijo que ese movimiento debía ocurrir y estableció qué variables lo determinaban. La comparación entre sus predicciones detalladas y las observaciones del movimiento browniano por Jean Perrin en 1908 fueron la pieza que terminó de convencer a la mayoría de los escépticos restantes hasta ese momento sobre la realidad de los átomos. Este fenómeno, que es simple de montar experimentalmente y fascinante de ver, da una prueba visual sorprendente de que las partes más pequeñas de toda la materia en el Universo están realmente en un perpetuo estado de movimiento animado y aleatorio.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

La paradoja de la recurrencia – Cuaderno de Cultura Científica
[…] éxito de la teoría cinética con la explicación de Einstein del movimiento browniano, junto con los descubrimientos en radioactividad y física atómica, convencieron a casi todos los […]
Adrián
Re bien explicado me encantó la parte de refrigeración de heladera y los detalles del gas.gracias
Einstein y su educación formal — Cuaderno de Cultura Científica
[…] dando clases particulares, siguió trabajando en su segunda tesis. El tema esta vez era sobre cómo usar el movimiento browniano para medir el tamaño de los átomos. Con la estabilidad que le daba el empleo que había encontrado en la Oficina Federal de Patentes […]
La teoría de la invariancia — Cuaderno de Cultura Científica
[…] curso . Uno estos documentos proporcionó la teoría definitiva buscada desde hace tiempo para la existencia de átomos y moléculas y otro inició el desarrollo de la teoría cuántica de la […]
Einstein y el movimiento browniano — Cuaderno de Cultura Científica
[…] el movimiento browniano. Desde ese punto de partida, continuó demostrando que podía usar las teorías del calor en vigor para describir cómo la energía térmica, incluso a temperatura ambiente, provocaría que las […]