El modelo de Bohr-Sommerfeld y las propiedades químicas de los elementos

En el modelo de Bohr (1913) los átomos de los diferentes elementos difieren en la carga y la masa de sus núcleos y en el número y disposición de los electrones. En 1916 Arnold Sommerfeld generalizó el modelo modificando las órbitas electrónicas [1]: ahora ya no eran solo circulares, también podían ser elípticas; y ya no eran como una serie de anillos concéntricos en un plano, sino figuras geométricas en tres dimensiones. ¿Cómo explica este modelo de Bohr-Sommerfeld las propiedades químicas de los elementos?
Los elementos hidrógeno (número atómico Z = 1) y litio (Z = 3) son algo similares químicamente. Ambos tienen valencia 1. Ambos entran en compuestos de estructura similar, por ejemplo, cloruro de hidrógeno (HCl) y cloruro de litio (LiCl). También hay algunas similitudes en sus espectros. Todo esto sugiere que el átomo de litio se parece al átomo de hidrógeno en algunos aspectos importantes. Bohr especuló que dos de los tres electrones del átomo de litio están relativamente cerca del núcleo, en órbitas que se asemejan a las del átomo de helio (Z = 2), formando lo que se puede describir como una «capa» alrededor del núcleo. Pero el tercer electrón está en una órbita circular o elíptica fuera del sistema interno. Dado que este sistema interno consiste en un núcleo de carga +3e y dos electrones, cada uno de los cuales tiene carga –e, su carga neta es +e. Por lo tanto, el átomo de litio puede representarse aproximadamente con un núcleo central de carga +e. Alrededor de este núcleo gira un electrón, algo así como si fuera un átomo de hidrógeno. Esta estructura física similar sería entonces la razón del comportamiento químico similar de hidrógeno y litio.
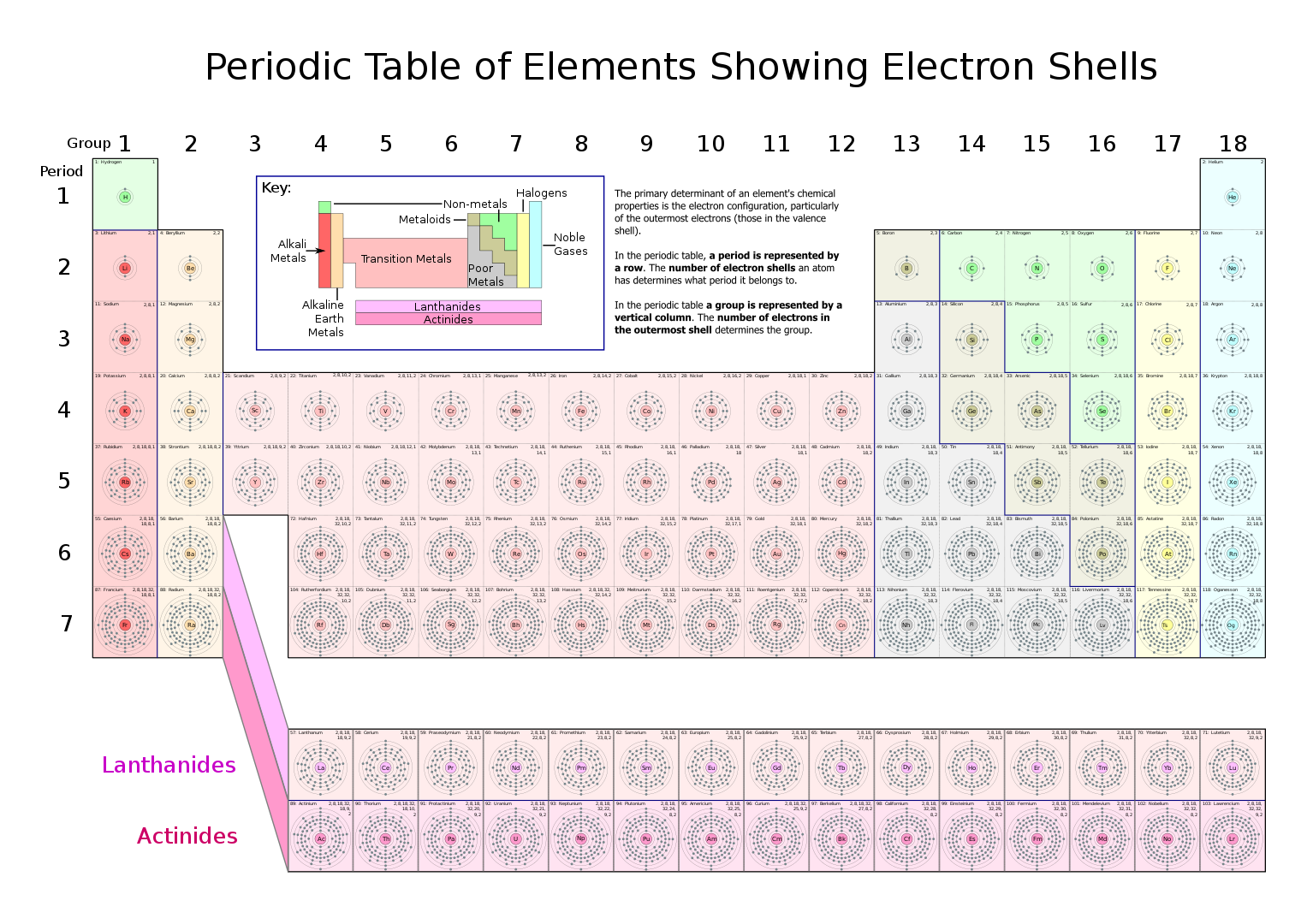
El helio (Z = 2) es un gas noble, químicamente inerte [2]. Estas propiedades indican que el átomo de helio debe ser altamente estable y que tiene sus dos electrones estrechamente unidos al núcleo [3]. Parece sensato, entonces, considerar que ambos electrones se mueven en la misma «capa» más interna cuando el átomo no está excitado. Además, debido a que el átomo de helio es tan estable y químicamente inerte, podemos suponer razonablemente que esta capa no puede contener más de dos electrones. Esta capa se llama K [4]. El único electrón del hidrógeno también está en la capa K cuando el átomo no está excitado. El litio tiene dos electrones en la capa K, llenándola completamente; el tercer electrón inicia una nueva capa, llamada L [4]. Este único electrón externo y débilmente ligado es la razón por la cual el litio se combina tan fácilmente con el oxígeno, el cloro y muchos otros elementos.
El sodio (Z = 11) es el siguiente elemento en la tabla periódica que tiene propiedades químicas similares a las del hidrógeno y el litio. Esta similitud sugiere que el átomo de sodio también es similar al hidrógeno al tener un núcleo central sobre el que gira un electrón. Además, así como el litio sigue al helio en la tabla periódica, el sodio sigue al gas noble neón (Z = 10). Podemos suponer que dos de los diez electrones del neón están en la primera capa (K), mientras que los ocho electrones restantes están en la segunda capa (L). Debido a que es químicamente inerte [2] y la estabilidad del neón, podemos suponer además que estos ocho electrones llenan la capa L hasta su capacidad. Para el sodio, entonces, el undécimo electrón debe estar en una tercera capa, llamada la capa M [4].
Si pasamos al potasio (Z = 19), el siguiente elemento del mismo grupo de la tabla periódica, podemos volver a imaginar un núcleo interno y un solo electrón fuera de él. El núcleo consta de un núcleo con carga +19e. Hay dos, ocho y ocho electrones que ocupan las capas K, L y M, respectivamente. El decimonoveno electrón gira alrededor del núcleo en una cuarta capa, llamada N. El átomo del gas noble argón, con Z = 18, aparece justo antes del potasio en la tabla periódica. El argón nuevamente tiene una estructura de electrones firme y estable, con dos en la capa K, ocho en la capa L y ocho en la capa M.
Parece que tenemos un patrón y que la cosa funciona. ¿Podremos construir todo el sistema de periodos usando solo el modelo de Bohr-Sommerfeld?
Notas:
[1] También introdujo velocidades relativistas para el electrón y determinó que las capas posteriores a la primera pueden tener subcapas, lo que introduciría un nuevo número cuántico. Pero esto ya lo contaremos en otra parte.
[2] A todos los efectos prácticos que nos interesan aquí.
[3] Ya que la química depende del intercambio de electrones. Si el átomo no reacciona químicamente es porque no intercambia sus electrones y esto se debe a que el núcleo los agarra con fuerza. Esto es una sobresimplificación, pero, por ahora, nos sirve.
[4] Los nombres de las capas vienen de la espectroscopía. No les busques lógica porque no la tienen más allá del orden alfabético. Tienen historia, pero es irrelevante ahora.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance
La estructura de la tabla periódica se deduce de la estructura de capas de los átomos — Cuaderno de Cultura Científica
[…] consideraciones cualitativas sobre el comportamiento químico de los elementos desde el punto de vista del modelo de […]
Victoria Gil
Fascinante!!! No se mucho de química pero me encantan estos temas xq contribuyen en mi desarrollo cognitivo. Gracias.
La estructura de la tabla periódica se deduce de la estructura de capas de los átomos – Judith Chao Andrade
[…] Las consideraciones cualitativas sobre el comportamiento químico de los elementos desde el punto de vista del modelo de Bohr-Sommerfeld llevaron a un cuadro consistente en el que los electrones se distribuían en capas alrededor del núcleo atómico, creando una especie de “núcleo compuesto”. Estos “núcleos compuestos” no eran otra cosa que los gases nobles, que tenían una configuración electrónica especialmente estable. […]