Lo que llevamos visto en esta serie, cosas fáciles de entender, macroscópicas, en las que solo hemos empleado algunas relaciones matemáticas muy elementales, nos sobra y nos basta junto con alguna definición adicional para establecer dos de las leyes fundamentales del universo. Así, como suena. En ambos casos son afirmaciones de imposibilidad, es decir, establecen que hay cosas imposibles. veremos en esta entrega la primera y veremos la segunda en la próxima.

La primera ley de la termodinámica es una generalización de la conservación de la energía en los procesos térmicos. Se basa en la conclusión de Joule de que el calor y la energía son equivalentes. Pero para llegar a ella hay que sortear algunas trampas en el camino.
A partir de la conclusión de Joule podríamos caer en la tentación de llamar al calor energía «interna» asociada con la temperatura. Podríamos entonces agregar calor a las energías potencial y cinética de un sistema, y llamar a esta suma la energía total, que es lo que conservaría. De hecho, esta solución funciona bien para una gran variedad de fenómenos, incluyendo los experimentos de Joule. Los problemas surgen con la idea de «contenido» de calor de un sistema. Por ejemplo, cuando se calienta un sólido hasta su punto de fusión, una “entrada de calor” adicional provoca la fusión pero sin aumentar la temperatura. Con este sencillo experimento vemos que considerar simplemente la energía térmica medida solo por un aumento de temperatura como parte de la energía total de un sistema no dará una ley general completa.
En lugar de «calor», podemos usar el concepto de energía interna, esto es, una energía en el sistema que puede tomar formas no directamente relacionadas con la temperatura. Podemos entonces usar la palabra «calor» para referirnos solamente a una transferencia de energía entre un sistema y su entorno. De forma análoga, el término trabajo no lo utilizaremos para describir algo contenido en el sistema, sino que describe una transferencia de energía de un sistema a otro. Calor y trabajo son, pues, dos formas en las que la energía se transfiere, no energías.
Estas definiciones no permiten una declaración simplista como “la entrada de calor a un sistema aumenta su energía interna, y el trabajo hecho en un sistema aumenta su energía mecánica”. La entrada de calor a un sistema puede tener efectos distintos al aumento de la energía interna. En un máquina de vapor, por ejemplo, la entrada de calor aumenta la energía mecánica del pistón. Del mismo modo, el trabajo realizado en un sistema puede tener efectos distintos al aumento de la energía mecánica. Al frotarnos las manos en un día frío, por ejemplo, el trabajo que hacemos aumenta la energía interna de la piel de las manos lo que, en este caso, se traduce en un aumento de la temperatura.
En resumen, una ley general de conservación de la energía debe incluir la transferencia de energía como trabajo y la transferencia energía como calor. Además, debe incluir el cambio en la energía total del sistema, pero no con una parte «mecánica» y una parte «interna».
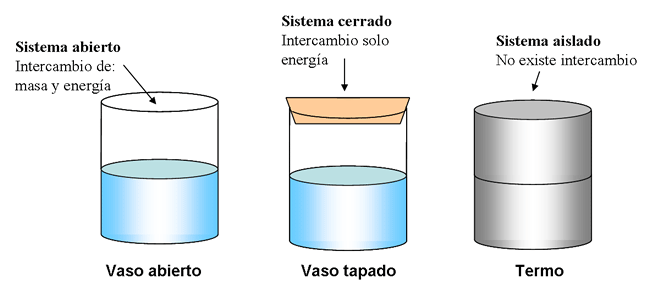
En un sistema aislado, esto es, un sistema que no intercambia materia ni energía con su entorno, la energía total debe permanecer constante. Si el sistema intercambia energía con su entorno pero no materia (lo que se llama sistema cerrado), puede hacerlo solo de dos formas: una transferencia de energía bien en forma de trabajo realizado sobre o por el sistema, bien en forma de calor hacia o desde el sistema. En el caso de que exista transferencia de energía, el cambio en la energía del sistema debe ser igual a la energía neta ganada o perdida por el entorno.
Formalmente*, llamemos W al trabajo realizado sobre o por el sistema (como el cilindro en una máquina de vapor). Si el trabajo lo realiza el sistema, diremos que W es negativo; si el trabajo se realiza sobre el sistema, diremos que W es positivo. De forma similar, llamemos ΔQ a la transferencia neta de calor hacia o desde el sistema. Si la transferencia neta de calor es hacia el sistema, ΔQ será positiva; si la transferencia neta sale del sistema, ΔQ será negativa.
Ya lo tenemos todo para enunciar la primera ley de la termodinámica:
La primera ley de la termodinámica establece que el cambio en la energía total de un sistema cerrado, ΔE, viene dado por la suma del trabajo realizado sobre o por el sistema y la transferencia neta de calor hacia o desde el sistema. Simbólicamente, ΔE = W + ΔQ.
Esta expresión general incluye como casos especiales las versiones preliminares de la ley de conservación de la energía que hemos dado en entregas anteriores de esta serie. Si no hay transferencia de calor en absoluto, entonces ΔQ = 0, y ΔE = W. En este caso, el cambio en la energía de un sistema es igual al trabajo realizado sobre o por él. Por otra parte, si no se realiza trabajo ni sobre ni por el sistema, entonces W = 0 y ΔE = ΔQ. En este caso el cambio en la energía del sistema es igual a la transferencia neta de calor.
Esta ecuación tan sencilla es de una utilidad tremenda. Pero, si bien hemos enunciado la primera ley, aún queda un misterio por resolver, que es la estructura de esa energía interna de la que, de momento, solo sabemos que en algunos casos está relacionada con la temperatura y cómo se relaciona con la energía total del sistema. Lo veremos más adelante en esta serie, cuando tengamos la necesidad de introducir el concepto de átomo. Algo que, hasta ahora, no nos ha hecho falta.
Nota:
* Este criterio de signos es importante, ya que varía en función del autor. Nosotros empleamos el criterio más intuitivo, a saber, tomar al sistema como referencia. Por tanto, lo que recibe el sistema es positivo y aumenta su energía total y lo que sale del sistema es negativo y la disminuye. Si usas este texto como apoyo en tus clases comprueba que el criterio de signos es el mismo.
Sobre el autor: César Tomé López es divulgador científico y editor de Mapping Ignorance

La fe en las leyes de conservación – Cuaderno de Cultura Científica
[…] [2] La teoría de la relatividad y los estudios de las reacciones nucleares, como en el caso del neutrino, permitió generalizar la ley de conservación de la energía a la ley de conservación de la masa-energía, siendo masa y energía dos formas equivalentes según E = mc2, donde c es la velocidad de la luz en el vacío. Esto no es más que una generalización de la primera ley de la termodinámica. […]
La ley del gas ideal y la tercera ley de la termodinámica – Cuaderno de Cultura Científica
[…] a ser líquido. Por lo tanto, no es una ley de la física en el mismo sentido que la majestuosa ley de la conservación de la energía, que es válida en todas las […]
¿Qué es Función de Gibbs? – Su Definición, Concepto y Significado
[…] la condición de estabilidad y espontaneidad para una reacción química. la segunda ley de la termodinámica, sostiene que una reacción química natural, hace posible que la energía presente en el universo […]
Una fórmula para dominarlos a todos: El trabajo – Cuaderno de Cultura Científica
[…] derivable de nuestra vieja amiga, la conservación de la energía que, como ya os contamos aquí, es de los asuntos que más claro vemos (aunque haya quien siga buscando un móvil perpetuo de […]
Sistema
[…] mayor es la simplicidad de los sistemas. Ejemplo de ello se puede observar dentro de la segunda ley de la termodinámica, la cual afirma que con el tiempo la entropía de los sistemas se […]
Usos y transformaciones de la energía – Probio-project.com
[…] acuerdo a la Primera Ley de la Termodinámica, la energía se encuentra transformándose constantemente llegando a pasar de una forma a otra. En […]
Lenard Cabrera
Quedé con la duda del ejemplo que dan del carro, por qué no aplica ennel la primera ley de la termodinámica?
César Tomé
Siga estos pasos:
1. Lea atentamente la definición que damos de la primera ley de la termodinámica.
2. Fíjese en la ilustración con los vasos de agua.
3. Determine qué tipo de sistema termodinámico es el Chiron.
4. En este momento la respuesta debería parecerle obvia.
El Creador de carne y hueso: demostrado por palabra de poder – Considere la Buena Noticia
[…] Masa-Energía, la ciencia no ha encontrado ningún proceso natural que cree Masa-Energía. La Primera ley de la termodinámica, (o la Ley de Conservación de Masa-Energía), la ley más verificada y observada de la ciencia […]